9/2017. (V. 31.) EMMI rendelet
a törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet és a finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet módosításáról1
2017.06.01.
1. A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet módosítása
(E rendelet alkalmazásában:)
„k) egészségügyi technológiaértékelés: az egészségügyi technológiákat eredményesség, hatékonyság, költséghatékonyság, gazdasági és társadalmi következmények szempontjából értékelő eljárások összessége;
l) formai és tartalmi ellenőrzés: a kérelmezőtől beérkezett kérelem formai és tartalmi ellenőrzése, értékelése, melyet valamennyi gyógyszer befogadási kérelem esetén el kell végezni;”
„(3) A (2) bekezdés szerinti kérelmek esetén a kérelemhez benyújtott egészségügyi technológiaértékelés a 2. § l) pontja szerinti formai és tartalmi ellenőrzést követő, szükség esetén az OGYÉI által végzett további technológiaértékelés, mellyel igazolni lehet a technológia megfelelőségét.” 4. § Az R1. 3. számú melléklet EÜ70 24. pontjában a „Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház” szövegrész helyébe a „Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház” szöveg lép.
7. § Ez a rendelet 2017. június 1-jén lép hatályba.
1. melléklet a 9/2017. (V. 31.) EMMI rendelethez
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
|
NORMATÍV |
EMELT
INDI- KÁCIÓ- HOZ KÖTÖTT |
KIEMELT
INDI- KÁCIÓ- HOZ KÖTÖTT |
KÜLÖN- KERET) |
|
0% |
25% |
55% |
80% |
|
ÉRTÉK NÉLKÜL |
ÁTLAGON ALULI |
ÁTLAGOS |
ÁTLAGON FELÜLI |
|
„ |
|
|
|
|
|
|
|
|
|
M05BB |
bisphosphonát kombináció |
X |
|
|
|
X |
X |
|
|
(ATC |
ATC MEGNEVEZÉS |
TÁMOGATÁSI KATEGÓRIÁK |
|
NORMATÍV |
EMELT
INDI- KÁCIÓ- HOZ KÖTÖTT |
KIEMELT
INDI- KÁCIÓ- HOZ KÖTÖTT |
KÜLÖN- KERET) |
|
0% |
25% |
55% |
80% |
|
ÉRTÉK NÉLKÜL |
ÁTLAGON ALULI |
ÁTLAGOS |
ÁTLAGON FELÜLI |
|
„ |
|
|
|
|
|
|
|
|
|
N04BA |
dopa és dopa származékok |
X |
X |
|
|
X |
X |
|
2. melléklet a 9/2017. (V. 31.) EMMI rendelethez
– Tartós házi oxigénellátásban részesülő beteg részére, akinek életvitelében dokumentáltan jelentős javulást eredményez az oxigéngázhoz képest, a beteg részére történő betanítással és átadással
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
|
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
|
Járóbeteg szakrendelés/
Fekvőbeteg gyógyintézet |
Tüdőgyógyászat |
javasolhat és írhat |
|
Járóbeteg szakrendelés/
Fekvőbeteg gyógyintézet |
Kardiológia |
javasolhat és írhat |
|
Háziorvos |
Megkötés nélkül |
javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
– Malignus tumor következtében fellépő csontmetasztázisok
– Myeloma multiplex ossealis manifestatiói
– Tumoros hypercalcaemia, de kizárólag a készítmény alkalmazási előírásában szerepelő javallatok figyelembevételével.”
|
Város |
Intézmény neve |
|
Ajka |
Magyar Imre Kórház-Rendelőintézet |
|
Budapest |
Heim Pál Gyermekkórház |
|
Budapest |
Országos Korányi TBC és Pulmonológiai Intézet |
|
Budapest |
Semmelweis Egyetem I–II. sz. Gyermekgyógyászati Klinika, Pulmonológiai Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Gyermekklinika, Tüdőgyógyászati Klinika |
|
Debrecen |
Kenézy Gyula Kórház és Rendelőintézet |
|
Deszk |
Csongrád Megye Mellkasi Betegségek Szakkórháza |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
|
Mosdós |
Somogy Megyei Kaposi Mór Oktató Kórház Mosdósi Telep |
|
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Gyermekgyógyászati Klinika |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Gyermekgyógyászati Klinika A és B részlege |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Törökbálint |
Tüdőgyógyintézet Törökbálint |
|
Zalaegerszeg |
Zala Megyei Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Országos Korányi TBC és Pulmonológiai Intézet |
|
Budapest |
Semmelweis Egyetem Pulmonológia Klinika |
|
Budapest |
Semmelweis Egyetem I–II. sz. Gyermekgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Tüdőgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Gyermekgyógyászati Intézet |
|
Deszk |
Csongrád Megyei Mellkasi Betegségek Szakkórháza, I. sz. Tüdőgyógyászati Osztály |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Mátraháza |
Mátrai Gyógyintézet |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, I. sz. Belgyógyászati Klinika, Tüdőgyógyászat |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Gyermekgyógyászati Klinika |
|
Törökbálint |
Tüdőgyógyintézet Törökbálint |
|
Szeged |
Szegedi Tudományegyetem Általános Orvostudományi Kar Gyermekgyógyászati Klinika és Gyermek Egészségügyi Központ, Tüdőgyógyászati Tanszék |
|
Város |
Intézmény neve |
|
Budapest |
Heim Pál Gyermekkórház |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Magyar Honvédség Egészségügyi Központ, I. Belgyógyászati Osztály |
|
Budapest |
Semmelweis Egyetem I., II., III. sz. Belgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Belgyógyászati Klinika |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
|
Mosonmagyaróvár |
Karolina Kórház |
|
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, I. sz. Belgyógyászati Klinika |
|
Sopron |
Országos Vérellátó Szolgálat |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, II. sz. Belgyógyászati Klinika |
|
Szekszárd |
Tolna Megyei Balassa János Kórház |
|
Szolnok |
Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Tatabánya |
Szent Borbála Kórház, Belgyógyászat Onko-Hematológia részlege |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Bajcsy-Zsilinszky Kórház és Rendelőintézet |
|
Budapest |
Heim Pál Gyermekkórház |
|
Budapest |
Országos Onkológiai Intézet |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Semmelweis Egyetem I. sz. Belgyógyászati Klinika, Urológiai Klinika |
|
Budapest |
Szent Margit Kórház |
|
Budapest |
Magyar Honvédség Egészségügyi Központ |
|
Budapest |
Uzsoki Utcai Kórház |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Onkológiai Klinika |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Onkoterápiás Klinika |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Onkoterápiás Klinika |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Zalaegerszeg |
Zala Megyei Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Bajcsy-Zsilinszky Kórház és Rendelőintézet |
|
Budapest |
Heim Pál Gyermekkórház |
|
Budapest |
Országos Onkológiai Intézet |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Semmelweis Egyetem I. sz. Belgyógyászati Klinika, Urológiai Klinika |
|
Budapest |
Szent Margit Kórház |
|
Budapest |
Magyar Honvédség Egészségügyi Központ |
|
Budapest |
Uzsoki Utcai Kórház |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Onkológiai Klinika |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Onkoterápiás Klinika |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Onkoterápiás Klinika |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Zalaegerszeg |
Zala Megyei Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet |
|
Budapest |
Heim Pál Gyermekkórház |
|
Budapest |
Magyar Honvédség Egészségügyi Központ, I. Belgyógyászati Osztály |
|
Budapest |
Semmelweis Egyetem I. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem II. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem III. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem I. sz. Gyermekgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem II. sz. Gyermekgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Belgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Gyermekklinika |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
|
Mosonmagyaróvár |
Karolina Kórház |
|
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, Gyermekgyógyászati Klinika |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, I. sz. Belgyógyászati Klinika |
|
Sopron |
Országos Vérellátó Szolgálat |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Belgyógyászati Klinika Haematológiai Osztály |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Gyermekgyógyászati Klinika |
|
Szekszárd |
Tolna Megyei Balassa János Kórház |
|
Szolnok |
Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház, Haematológiai és Haemostaseológiai Osztály |
|
Tatabánya |
Szent Borbála Kórház, Belgyógyászat Onko-Hematológia részlege |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Magyar Honvédség Egészségügyi Központ, I. Belgyógyászati Osztály |
|
Budapest |
Egyesített Szent István és Szent László Kórház-Rendelőintézet Haematológiai és Csontvelőtranszplantációs Osztály, I. Belgyógyászat |
|
Budapest |
Semmelweis Egyetem I. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem II. sz. Belgyógyászati Klinika |
|
Budapest |
Semmelweis Egyetem III. sz. Belgyógyászati Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Belgyógyászati Intézet |
|
Győr |
Petz Aladár Megyei Oktató Kórház II. sz. Belgyógyászat-Haematológiai Osztály |
|
Gyula |
Békés Megyei Központi Kórház |
|
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
|
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
|
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, I. sz. Belgyógyászati Klinika |
|
Sopron |
Országos Vérellátó Szolgálat |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, II. sz. Belgyógyászati Klinika |
|
Szekszárd |
Tolna Megyei Balassa János Kórház |
|
Szolnok |
Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Tatabánya |
Szent Borbála Kórház, Belgyógyászat Onko-Haematológiai részlege |
|
Veszprém |
Csolnoky Ferenc Kórház |
|
Város |
Intézmény neve |
|
Budapest |
Magyar Honvédség Egészségügyi Központ |
|
Budapest |
Országos Onkológiai Intézet |
|
Budapest |
Semmelweis Egyetem |
|
Debrecen |
Debreceni Egyetem Klinikai Központ |
|
Debrecen |
Kenézy Gyula Kórház és Rendelőintézet |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Város |
Intézmény neve |
|
Budapest |
Országos Korányi TBC és Pulmonológiai Intézet |
|
Budapest |
Semmelweis Egyetem Pulmonológiai Klinika |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Tüdőgyógyászati Klinika |
|
Deszk |
Csongrád Megye Mellkasi Betegségek Szakkórháza |
|
Győr |
Petz Aladár Megyei Oktató Kórház |
|
Mátraháza |
Mátrai Gyógyintézet |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ, I. sz. Belgyógyászati Klinika, Tüdőgyógyászat |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
|
Székesfehérvár |
Fejér Megyei Szent György Egyetemi Oktató Kórház Pulmonológia |
|
Szombathely |
Markusovszky Egyetemi Oktatókórház |
|
Törökbálint |
Tüdőgyógyintézet Törökbálint |
Előrehaladott Parkinson-kór esetén levodopára reagáló, súlyos motoros fluktuációval és hyper-/dyskinesiával járó betegeknek, ha a rendelkezésre álló egyéb antiparkinson szerek kombinációi nem hoznak kielégítő eredményt és műtétre (mély agyi stimuláció, DBS) nem alkalmasak, valamint súlyos dementia kizárása esetén. A terápia hatástalannak tekinthető, ha a betegség progrediált és a beteg állapota Duodopa terápia mellett a Hoehn & Yahr skála szerint 5. stádiumú. A beteg állapotát legalább évente orvosilag dokumentálni kell.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
|
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
|
Kijelölt intézmény |
Neurológus |
írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
|
Város |
Intézmény neve |
|
Budapest |
Semmelweis Egyetem |
|
Debrecen |
Debreceni Egyetem Klinikai Központ, Neurológiai Klinika |
|
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
|
Pécs |
Pécsi Tudományegyetem Klinikai Központ |
|
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
a) EÜ100 7/a., EÜ100 7/b., EÜ100 8/t., EÜ100 23/a., EÜ100 34., EÜ100 35., EÜ100 37/a., EÜ100 41., EÜ100 42., EÜ100 43., EÜ100 51. pontjában a „Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház” szövegrész helyébe a „Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház” szöveg,
b) EÜ100 36/a., EÜ100 36/c., EÜ100 63. pontjában a „Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktatókórház” szövegrész helyébe a „Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház” szöveg
a) EÜ100 36/a., EÜ100 36/c. pont „Kijelölt intézmények:” részében foglalt táblázatban a következő sor:
|
Miskolc |
Miskolci Semmelweis Kórház és Egyetemi Oktatókórház |
b) EÜ100 42. pont „Kijelölt intézmények:” részében foglalt táblázatban a következő sor:
|
Miskolc |
Semmelweis Kórház II. sz. Belgyógyászati Osztály |
3. melléklet a 9/2017. (V. 31.) EMMI rendelethez
(A veleszületett vérzékenység kezelésére:)
„v) rekombináns technológiával, humán sejtvonalon előállított, 4. generációs, elnyújtott felezési idejű VIII. faktor koncentrátum, Fc fúziós fehérje.”
[Krónikus aktív hepatitis C kezelésére (a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján):]
„o) elbasvir/grazoprevir.”
4. melléklet a 9/2017. (V. 31.) EMMI rendelethez
Képviselő cég neve, címe:
Ügyintéző neve, elérhetősége:
Munkahelyi telefon (fax, e-mail, mobiltel.):
Kérelem gyógyszer társadalombiztosítási támogatására
1. Gyógyszer megnevezése, kiszerelése a forgalomba hozatali engedély szerint:
2. Gyógyszerre vonatkozó adatok:
2.1. Nemzetközi szabad név (hatóanyag neve a törzskönyv szerint):
2.2. Gyógyszer besorolása (World Health Organization/Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet ötszintű, hétjegyű ATC besorolás):
2.3. Hatáserősség (hatóanyag mennyisége egy kiszerelési egységben):
2.4. Gyógyszer kiszerelési forma (külön feltüntetve a gyógyszerformát és a csomagolást):
2.5. Kiadhatóság (a megfelelő jelölendő):
2.6. Törzskönyvezés időpontja, száma:
2.7. A készítmény EAN kódja:
2.8. Gyártó cég megnevezése (cím):
2.9. Forgalomba hozatali engedély jogosultja (ország, cím):
2.10. Kért termelői, illetve import beszerzési ár (Ft):
2.11. Kért támogatási kategória:
2.11.1. kiemelt, indikációhoz kötött támogatás
2.11.1.1. meglévő támogatott indikáció, egészségügyi rendelkezés megjelölése,
2.11.1.2. létesítésre javasolt indikáció;
2.11.2. emelt indikációhoz kötött támogatás
2.11.2.1. meglévő támogatott indikáció, egészségügyi rendelkezés megjelölése,
2.11.2.2. létesítésre javasolt indikáció;
2.11.3. átlagon felüli támogatás;
2.11.4. átlagos támogatás;
2.11.5. átlag alatti támogatás;
2.11.6. támogatási érték nélkül
2.11.6.2. az R. 4. § (8) bekezdés b) pontja szerint azon gyógyszerek, amelyeket a Nemzeti Egészségbiztosítási Alapkezelő támogatási érték nélkül fogad be; 2.11.7. közbeszerzés útján beszerzett gyógyszerek esetén
2.11.7.1. különkeretes gyógyszerek körébe,
2.11.7.2. speciális támogatási technika megjelölésével, tételes elszámolás alá.
2.12.1. új gyógyszerformára és új beviteli formára;
2.12.4. új kombinációra, ha az összetételben szereplő valamely hatóanyag nem támogatott;
2.12.6. támogatási kategória változására;
2.12.7. már támogatott hatóanyag új – nem egyenértékű – gyógyszerére;
2.12.8. jelentős terápiás előnnyel rendelkező készítményre, magasabb áron történő befogadásra és a támogatás megállapítására
2.13. A kérelmezett indikáció megnevezése:
A gyártó által forgalmazott készítmény neve, kiszerelése, hatóanyag-tartalma, hatáserőssége, termelői ára és támogatása az alábbi országokban:
|
Ország |
Név |
Kisze-
relési
egység |
Ható-
anyag- tartalom/
kiszerelési egység** |
Összható-
anyag-
tartalom |
Forga-
lomba kerülés éve |
Jelenlegi termelői/
EGT-n
kívüli országból történő behozatal esetén import beszer-
zési ár* |
Támo-
gatás
mértéke a kérel-
mezett indikációban
% |
Termelői áron számított forgalom
(a kérelem beadását megelőző naptári év alapján) |
Forgal-
mazott
meny-
nyiség
(doboz) |
|
Franciaország |
|
|
|
|
|
|
|
|
|
|
Írország |
|
|
|
|
|
|
|
|
|
|
Németország |
|
|
|
|
|
|
|
|
|
|
Spanyolország |
|
|
|
|
|
|
|
|
|
|
Portugália |
|
|
|
|
|
|
|
|
|
|
Olaszország |
|
|
|
|
|
|
|
|
|
|
Görögország |
|
|
|
|
|
|
|
|
|
|
Lengyelország |
|
|
|
|
|
|
|
|
|
|
Csehország |
|
|
|
|
|
|
|
|
|
|
Szlovénia |
|
|
|
|
|
|
|
|
|
|
Szlovákia |
|
|
|
|
|
|
|
|
|
|
Belgium |
|
|
|
|
|
|
|
|
|
|
Ausztria |
|
|
|
|
|
|
|
|
|
|
Bulgária |
|
|
|
|
|
|
|
|
|
|
Ciprus |
|
|
|
|
|
|
|
|
|
|
Dánia |
|
|
|
|
|
|
|
|
|
|
Egyesült Királyság |
|
|
|
|
|
|
|
|
|
|
Észtország |
|
|
|
|
|
|
|
|
|
|
Finnország |
|
|
|
|
|
|
|
|
|
|
Hollandia |
|
|
|
|
|
|
|
|
|
|
Lettország |
|
|
|
|
|
|
|
|
|
|
Litvánia |
|
|
|
|
|
|
|
|
|
|
Luxemburg |
|
|
|
|
|
|
|
|
|
|
Málta |
|
|
|
|
|
|
|
|
|
|
Románia |
|
|
|
|
|
|
|
|
|
|
Svédország |
|
|
|
|
|
|
|
|
|
|
Svájc |
|
|
|
|
|
|
|
|
|
|
Norvégia |
|
|
|
|
|
|
|
|
|
|
Horvátország |
|
|
|
|
|
|
|
|
|
|
Egyéb |
|
|
|
|
|
|
|
|
|
* Euróban (a kérelem beadásának hónapját megelőző hat hónap hivatalos napi MNB deviza középárfolyamon számolt számtani átlaga).
** Védőoltások/immunbiológia termékek esetében:
Hatóanyag-tartalom/kiszerelési egység helyett az alapvédettség eléréséhez szükséges adag kiszerelési egységeinek összessége.
Összhatóanyag-tartalom oszlop nem töltendő ki.
NTK helyett az alapvédettség eléréséhez szükséges összdózis költsége. Plazmakészítmények esetében: a hatóanyag-tartalom helyett NE/nemzetközi egység alkalmazandó, NTK nem töltendő ki.
2.15. Már támogatott hatóanyag esetén:
Azonos hatóanyagot tartalmazó és azonos beviteli formájú, Magyarországon forgalomba hozatalra engedélyezett készítmények megnevezése, fogyasztói ára, támogatása és napi terápiás költsége:
Még nem támogatott hatóanyag esetén:
Azonos négyszintű, ötjegyű ATC csoportba tartozó és azonos alkalmazási módú, Magyarországon forgalomba hozatalra engedélyezett készítmények megnevezése, fogyasztói ára, támogatása és napi terápiás költsége:
(Ha a négyszintű, ötjegyű ATC csoportban nem szerepel készítmény, a forgalomba hozatali engedély jogosultja által elkészített és benyújtott költséghatékonysági tanulmányban szereplő összehasonlító készítményekre vonatkozóan kell kitölteni.)
|
Név |
Hatáserősség |
Kiszerelés |
Fogyasztói ár |
Támogatás |
NTK* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Az NTK-t WHO DDD alapján (valamint ha eltérő, a forgalomba hozatalra engedélyező hatóság alkalmazási előírásában feltüntetett napi dózis alapján), fogyasztói áron forintban kérjük feltüntetni.
* Védőoltások/immunbiológia termékek: NTK helyett az azonos kezelési/terápiás céllal alkalmazott és azonos beviteli formájú, Magyarországon forgalomba hozatalra engedélyezett védőoltások alapvédettség eléréshez szükséges összdózis költsége.
* Plazmakészítmények esetében NTK nem töltendő ki.
2.16. A vonatkozó indikációban, egészségügyi rendelkezés alapján rendelhető azonos négyszintű, ötjegyű ATC csoportba tartozó és azonos beviteli formájú, Magyarországon forgalomba hozatalra engedélyezett készítmények megnevezése, fogyasztói ára, támogatása és napi terápiás költsége:
|
Név |
Hatáserősség |
Kiszerelés |
Fogyasztói ár |
Támogatás |
NTK* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Az NTK-t WHO DDD alapján (valamint ha eltérő, a forgalomba hozatalra engedélyező hatóság alkalmazási előírásában feltüntetett napi dózis alapján), fogyasztói áron forintban kérjük feltüntetni.
* Védőoltások/immunbiológia termékek: NTK helyett az azonos kezelési/terápiás céllal alkalmazott és azonos beviteli formájú, Magyarországon forgalomba hozatalra engedélyezett védőoltások alapvédettség eléréshez szükséges összdózis költsége.
* Plazmakészítmények esetében NTK nem töltendő ki.
a) Napi átlag dózis: WHO által ajánlott DDD (forgalomba hozatalra engedélyező hatóság alkalmazási előírásában feltüntetett napi dózis is, ha eltérő):
b) (Ha a gyógyszer több indikációban kerül felhasználásra, a kérdést a főbb indikációk szerinti bontásban kell megválaszolni.)
|
Hatóanyagnév
(ha szükséges, feltüntetni a hatóanyag sóját is) |
WHO DDD
(adagolás módja szerint) |
|
|
|
|
|
|
|
|
|
|
Indikáció |
|
|
Diagnózis |
Ha testsúly, illetve életkor függő, kérjük külön feltüntetni |
Az alkalmazási előírásban feltüntetett dózis |
|
|
Kor |
Testsúly/
testfelület |
Kísérő betegség |
Kezdő |
Napi átlagos |
Maximális |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.18. Terápia, kúra átlagos időtartama (törzskönyvező hatóság alkalmazási előírásában feltüntetett kúra átlagos időtartama is, ha eltérő):
(Ha a gyógyszer több indikációban kerül felhasználásra, akkor a kérdést a főbb indikációk szerinti bontásban kell megválaszolni.)
|
Indikáció |
|
|
|
|
Diagnózis |
Ha testsúly, illetve életkor függő, kérjük külön feltüntetni |
A kúra átlagos hossza |
A kúra teljes költsége termelői áron |
A kúra teljes költsége fogyasztói áron |
|
|
Kor |
Testsúly/
testfelület |
Kísérő betegség |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. A kérelmezett egészségügyi technológia orvosszakmai bemutatása az Emberi Erőforrások Minisztériuma szakmai irányelve az egészségügyi technológia értékelés módszertanáról és ennek keretében költséghatékonysági elemzések készítéséről (az Egészségügyi Közlöny 2017. évi 3. számában megjelent EMMI közlemény szerint, a felhasznált dokumentumok és szakértői becslések mellékelésével) alapján.
a) A kérelmezett egészségügyi technológia orvosi gyógyító folyamatban betöltött helye. A gyógyszer elbírálásához, hatásának, mellékhatásának követéséhez szükséges orvosi kezelési folyamatának leírása, ellenőrző vizsgálatok bemutatása.
b) Az összehasonlításra kerülő gyógyító-megelőző technológiák ismertetése, és kiválasztásuk indoklása.
c) A kérelmezett egészségügyi technológia klinikai vizsgálatainak bemutatása.
d) Az adott egészségügyi eljárás alkalmazását támogató egyéb szempontok ismertetése.
4. A kérelmezett egészségügyi technológia egészség-gazdaságtani bemutatása és az elkészített magyar nyelvű, illetve magyar adaptációjú technológia elemzése az Emberi Erőforrások Minisztériuma szakmai irányelve az egészségügyi technológia értékelés módszertanáról és ennek keretében költséghatékonysági elemzések készítéséről (az Egészségügyi Közlöny 2017. évi 3. számában megjelent EMMI közlemény szerint, a felhasznált dokumentumok és szakértői becslések mellékelésével) alapján. Ha az egészség-gazdaságtani elemzés modell adaptáción alapul, az egészség-gazdaságtani modell beadása kötelező.
5. A kérelmezett egészségügyi technológia betegszám-becslésének és költségvetési-hatás elemzésének bemutatása az Emberi Erőforrások Minisztériuma szakmai irányelve az egészségügyi technológia értékelés módszertanáról és ennek keretében költséghatékonysági elemzések készítéséről (az Egészségügyi Közlöny 2017. évi 3. számában megjelent EMMI közlemény szerint, a felhasznált dokumentumok és szakértői becslések mellékelésével) alapján.
a) A kezelésbe Magyarországon bevonható betegek számának becslése. (Ha a gyógyszer több indikációban kerül felhasználásra, a kérdést a főbb indikációk szerinti bontásban kell megválaszolni.)
|
|
Indikáció |
Prevalencia |
Incidencia |
Az adott technológiával való kezelésbe bevonható betegek száma |
|
Befogadás évében |
|
|
|
|
|
Befogadást követő évben |
|
|
|
|
|
Befogadás utáni
2. évben |
|
|
|
|
Védőoltások esetén nem kell kitölteni.
b) Piaci részesedések várható alakulásának bemutatása.
c) Költségvetési hatáselemzés.
6. A kérelemhez csatolásra került
□ az adott gyógyszer forgalomba hozatali engedélye,
□ a cégjegyzésre jogosult képviselő aláírási címpéldánya,
□ ha nem a cégjegyzésre jogosult képviselő jár el, az eljáró személy részére adott írásbeli meghatalmazás,
□ ha nem a forgalomba hozatali engedély jogosultja nyújtja be a kérelmet, az eljáró személy/szerv részére adott írásbeli meghatalmazás,
□ az igazgatási-szolgáltatási díj befizetéséről, illetve átutalásáról szóló igazolás.
7. Alulírott, kérelmező akként nyilatkozom, hogy a befogadásra ajánlott készítmény magyarországi forgalmazásának megkezdését .............. év ................ hó ............ napjára tervezem, és ezzel nem sértem a találmányok szabadalmi oltalmáról szóló 1995. évi XXXIII. törvény rendelkezéseit.
Dátum: ................................
Aláírás: ................................
II. EGYSZERŰSÍTETT ELJÁRÁS
Képviselő cég neve, címe:
Ügyintéző neve, elérhetősége:
Munkahelyi telefon (fax, e-mail, mobiltel.):
Kérelem gyógyszer társadalombiztosítási támogatására
1. Gyógyszer megnevezése, kiszerelése a forgalomba hozatali engedély szerint:
2. Gyógyszerre vonatkozó adatok:
2.1. Nemzetközi szabad név (hatóanyag neve a törzskönyv szerint):
2.2. Gyógyszer besorolása (World Health Organization/Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet ötszintű, hétjegyű ATC besorolás):
2.3. Hatáserősség (hatóanyag mennyisége egy kiszerelési egységben):
2.4. Gyógyszer kiszerelési forma (külön feltüntetve a gyógyszerformát és a csomagolást):
2.5. Kiadhatóság (a megfelelő jelölendő):
2.6. Törzskönyvezés időpontja, száma:
2.7. A készítmény EAN kódja:
2.8. Gyártó cég megnevezése (cím):
2.9. Forgalomba hozatali engedély jogosultja (ország, cím):
2.10. Kért termelői, illetve import beszerzési ár (Ft):
2.11. Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet által meghatározott egyenértékűségi csoport:
2.12. Kért támogatási kategória:
a) kiemelt, indikációhoz kötött támogatás,
aa) meglévő támogatott indikáció, egészségügyi rendelkezés megjelölése,
ab) létesítésre javasolt indikáció;
b) emelt indikációhoz kötött támogatás,
ba) meglévő támogatott indikáció, egészségügyi rendelkezés megjelölése,
bb) létesítésre javasolt indikáció;
c) átlagon felüli támogatás;
e) átlag alatti támogatás;
f) támogatási érték nélkül
g) közbeszerzés útján beszerzett gyógyszerek esetén
ga) különkeretes gyógyszerek körébe,
gb) speciális támogatási technika megjelölésével, tételes elszámolás alá.
a) már támogatott hatóanyagot tartalmazó gyógyszerrel egyenértékű készítmény
ac) új gyógyszerformájára és azonos beviteli formájára,
ad) új generikumára, márkanevű készítményére,
b) tápszer vagy forgalomba hozatalra engedélyezett, a Szabványos Vényminta Gyűjteményben vagy a Gyógyszerkönyvben is szereplő gyógyszer támogatására;
d) már támogatott biológiai gyógyszer valamely hatóanyagával azonos vagy hasonló hatóanyagot tartalmazó, generikumnak nem minősülő hasonló biológiai gyógyszerre;
e) kedvezményezetti státusz megítélésére
2.14. A kért indikációs pont megnevezése:
2.15. Már támogatott hatóanyag esetén töltendő ki.
Azonos hatóanyagot tartalmazó és azonos beviteli formájú, Magyarországon forgalomba hozatalra engedélyezett készítmények megnevezése, fogyasztói ára, támogatása és napi terápiás költsége:
|
Név |
Hatáserősség |
Kiszerelés |
Fogyasztói ár |
Támogatás |
Egységnyi hatóanyagár* |
Egyenértékűségi csoport |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Az egységnyi hatóanyagárat WHO DDD alapján (valamint ha eltérő, a forgalomba hozatalra engedélyező hatóság alkalmazási előírásában feltüntetett napi dózis alapján), termelői áron forintban kérjük feltüntetni.
* Védőoltások/immunbiológia termékek: egységnyi hatóanyagár helyett az azonos kezelési/terápiás céllal alkalmazott és azonos beviteli formájú, Magyarországon forgalomba hozatalra engedélyezett védőoltások alapvédettség eléréshez szükséges összdózis költsége.
2.16. Kedvezményezetti státusszal történő befogadást kér:
Ha a kedvezményezetti státusszal történő befogadásra irányul a kérelem, az I. rész 3–5. pontjában foglaltak bemutatása szükséges.
3. A kérelemhez csatolásra került
□ az adott gyógyszer forgalomba hozatali engedélye,
□ a cégjegyzésre jogosult képviselő aláírási címpéldánya,
□ ha nem a cégjegyzésre jogosult képviselő jár el, az eljáró személy részére adott írásbeli meghatalmazás,
□ ha nem a forgalomba hozatali engedély jogosultja nyújtja be a kérelmet, az eljáró személy/szerv részére adott írásbeli meghatalmazás,
□ az igazgatási-szolgáltatási díj befizetéséről, illetve átutalásáról szóló igazolás.
4. Alulírott, kérelmező akként nyilatkozom, hogy a befogadásra ajánlott készítmény magyarországi forgalmazásának megkezdését .............. év ................ hó ............ napjára tervezem, és ezzel nem sértem a találmányok szabadalmi oltalmáról szóló 1995. évi XXXIII. törvény rendelkezéseit.
Dátum: ................................
Aláírás: ................................
5. melléklet a 9/2017. (V. 31.) EMMI rendelethez
„4. Finanszírozás rendje, finanszírozási algoritmus
 ”
”6. melléklet a 9/2017. (V. 31.) EMMI rendelethez
4.4.1. A denoszumab monoklonális RANKL ellen ható antitest, a csontreszorpciót a RANK ligand gátlás útján célzottan csökkenti, hat a csontlebontás folyamatára, jelentősen növeli a csontdenzitást, és csökkenti mind a vertebrális, mind a nem-vertebrális csonttörések kockázatát. A denoszumab a csont trabekuláris és kortikális állományát is erősíti. A denoszumab terpápiás költsége miatt a finanszírozási rendben jelenleg a stroncium raneláttal esik egy kategóriába.
4.4.2. A denoszumab használata alternatív lehetőségként jön szóba. Az oszteoporotikus csonttörés primer prevenciójában, társadalombiztosítási támogatással alkalmazható azoknál a posztmenopauzás nő vagy 55 év feletti férfi betegeknél, akiknek az oszteoporózisa igazolt (BMD értéke –2,5 SD T-score alatti), és FRAX alapján számított 10 éves törési kockázata magas (általános >20%, illetve csípő >3%), ha a biszfoszfonát kezelés ellenjavallt vagy azzal szemben dokumentált intolerancia lép fel, vagy a biszfoszfonát legalább 12 hónapon át történő alkalmazása nem volt eredményes (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve oszteoporotikus csonttörés történt).
4.4.3. A raloxifen és teriparatid oszteoporotikus csonttörés primer prevenciójában való alkalmazását a társadalombiztosítás nem támogatja.”
„5. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
5.1. Az algoritmus posztmenopauzás nők és 55 év feletti férfiak oszteoporotikus csonttörését megelőző kezelésének sémáját mutatja be.
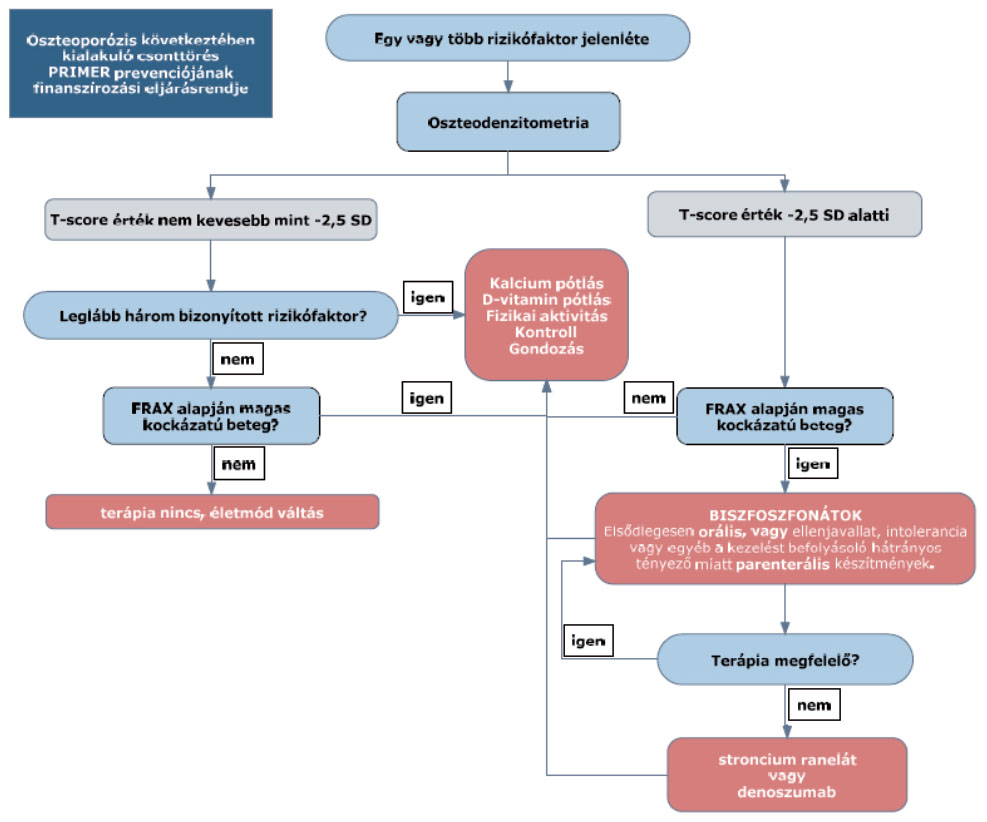 ”
”
|
|
(1 |
ATC |
ATC megnevezése) |
|
|
„ |
|
|
|
|
15 |
M05BX04 |
Denoszumab |
7. melléklet a 9/2017. (V. 31.) EMMI rendelethez
A hepatitis C vírus okozta krónikus májgyulladás diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Hepatitis C vírus által okozott idült májgyulladás B1820
a) Krónikus hepatitis C: a hepatitis C vírus fertőzés talaján kialakult idült májgyulladás.
b) Cirrhosis: az irányelv szempontjából ide értendők mindazok a betegek, akiknél szövettani vizsgálattal előrehaladott (bridging) fibrosis vagy definitív cirrhosis alakult ki (tehát Metavir és Knodell F3-F4 vagy Ishak F4-F5-F6), FibroScan vizsgálattal a máj stiffness 12 kPa feletti vagy Shear Wave Elastography vizsgálattal a LS >10,4 kPa vagy az Extended Liver Function (ELF) biokémiai teszt értéke >11,3 vagy más validált vizsgálómódszer cirrhosisra utal.
c) Prioritási Index: a májfibrosis mértékén alapuló, a májkárosodás súlyosságát és szövődményeit, a betegség aktivitását, az átvitel veszélyét és további meghatározott speciális szempontokat is figyelembe vevő, a HCV-fertőzött betegek kezelésbe vonásának szakmailag indokolt sorrendjét meghatározó numerikus érték.
d) Hepatitis Terápiás Bizottság: a krónikus vírushepatitises betegek ellátásában érintett szakmai szervezetek által létrehozott, a szervezetek által delegált tagokból álló testület.
e) Hepatitis Regiszter (HepReg): a szakmai szervezetek által létrehozott, a Nemzeti Egészségbiztosítási Alapkezelő (a továbbiakban: NEAK) gyógyszer-allokációját is támogató, a Hepatitis C vírussal fertőzött betegek és kezelésük nyilvántartására, valamint követésére létrehozott internet alapú adatbázis.
f) PR kettős kezelés: PegIFN+RBV kezelés.
g) PRP hármas kezelés: PegIFN+RBV+proteázgátló kezelés.
h) Bevezető (lead-in) kezelés: a PRP hármas kombinációs kezelés bevezetéseként alkalmazott PR kettős kezelés.
i) STOP-szabály: nem megfelelő vírusválasz miatti korai kezelés-befejezés.
j) Detekciós limit (DL): a HCV-RNS kimutathatóságának határértéke. A HCV kezelése során elvárás a 15 NE/ml-nél nem magasabb detekciós küszöbértékű real-time polimeráz láncreakció (rt-PCR) módszer alkalmazása.
k) Nem detektálható HCV: a HCV-RNS 15 IU/ml-nél nem nagyobb detekciós határú Real-Time PCR módszerrel nem mutatható ki.
l) Direkt ható antiviralis szerek (DAA): a hepatitis C vírus szaporodásának egyes fázisaira ható vegyületek. Csoportjai: proteázgátlók (PI, NS3-NS4A), NS5A replikációs komplex gátlók vagy NS5B polimerázgátlók.
m) Negatív PCR: a nem detektálható HCV-RNS jelent PCR negativitást.
n) Naiv-nak minősülő beteg: a finanszírozási eljárásrend szempontjából naiv-nak minősülnek mindazok, akik soha nem részesültek kezelésben, akik csak nem-pegilált IFN±RBV kezelésben részesültek, és akiknél a korábbi IFN±RBV kezelés nem STOP-szabály vagy súlyos mellékhatás miatt állt le.
o) Korábban sikertelenül kezelt beteg: a finanszírozási eljárásrend szempontjából mindazok, akik korábban legalább 12 hetes PR kettős vagy PRP hármas kezelés során nem váltak PCR negatívvá vagy vírusáttörés, illetve relapszus volt tapasztalható, vagy súlyos mellékhatás miatt a kezelés felfüggesztése vált szükségessé.
p) Null-reagáló beteg: PegIFN+RBV kezelés során a HCV-RNS-szint csökkenése 4 hét elteltével nem éri el az 1 log10 mértéket (nem csökken legalább 1/10-ed részére) vagy 12 hét elteltével nem érte el a 2 log10 nagyságrendet (nem csökken legalább 1/100-ad részére).
q) Részlegesen reagáló beteg: PegIFN+RBV kezelés során a HCV-RNS-szint 12 hét elteltével legalább 2 log10 mértékben csökkent, de a kezelés alatt mindvégig detektálható maradt.
r) Vírusáttörést mutató beteg: a kezelés alatt nem detektálható HCV-RNS később a kezelés során ismét kimutathatóvá vált.
s) Relabáló beteg: a kezelés befejezésekor a HCV-RNS nem detektálható, de a kezelés befejezése után ismét kimutatható.
t) Proteázgátló kezeléssel sikertelenül kezelt betegek: mindazok, akik PegIFN+RBV+PI kezeléssel nem gyógyultak meg (nem reagáltak, STOP-szabály alá estek vagy vírusáttörés, illetve relapsus vagy súlyos mellékhatás jelentkezett).
u) Rapid vírusválasz (RVR: rapid virologic response): a kezelés megkezdését követően 4 héttel a HCV-RNS nem mutatható ki.
v) Kiterjesztett rapid vírusválasz (eRVR): az IFN-alapú kezelés megkezdését követően a HCV-RNS a 4. és a 12. héten sem detektálható.
w) Tartós vírusválasz (SVR): a kezelés befejezését követően 24 héttel a HCV-RNS nem mutatható ki.
x) IFN-ellenjavallat: az IFN-készítmények alkalmazási előírásaiban felsorolt ellenjavallatok.
y) IFN-intolerancia: korábbi IFN-alapú kezelés során, azzal összefüggésben kialakult, a kezelés felfüggesztését eredményező, IFN ismételt adása esetén potenciálisan újra kialakuló súlyos mellékhatás.
z) Vírusrezisztencia (VR), rezisztencia-asszociált vírusvariáns (RAV), rezisztencia-asszociált szubsztitúció (RAS): a DAA-ra nem érzékeny HCV törzsek >10%-os gyakoriságú kimutathatósága a kezelés megkezdése előtt (kiinduló rezisztencia), vagy ilyen arányú felszaporodása DAA kezelés alatt (terápia-asszociált rezisztencia).
A hepatitis C vírus (HCV) okozta májgyulladás a transzfúziós hepatitisek leggyakoribb oka volt. A világban kb. 170 millióra becsülik a hepatitis C vírussal fertőzöttek számát, mely jelentős pandémiát jelent, mivel ez az össznépesség kb. 3%-a.
Magyarország lakosságának 0,7%-a, mintegy 70 000 ember lehet fertőzött hepatitis C vírussal (HCV), közülük körülbelül 50 000-re becsülhető a biztosan fertőzőképes HCV-RNS-pozitív egyének száma. Az érintettek többsége nem tud fertőzöttségéről. A fertőzöttek legnagyobb része vagy 1993 előtt kapott transzfúzióval vagy más egészségügyi beavatkozással fertőződött. A véradók szűrése (1992 óta) jelentősen csökkentette az infekció átvitelének gyakoriságát a korábbi 17%-ról a jelenlegi 0,001%-ra, de az új esetek megjelenése folyamatos, elsősorban az intravénásan alkalmazott kábítószerek elterjedtsége, valamint az egyéb parenterális átviteli lehetőségek miatt. A hazai fertőzöttek több mint 95%-ánál 1. genotípus (főleg 1b) mutatható ki.
Bizonyos fokozottan veszélyeztetett populációkban az előfordulás magas: politranszfundáltaknál (hemofiliások között) 50–80%, hemodializáltaknál 30–40%, intravénás droghasználók esetében 30–90% a HCV szeropozitívak aránya. A krónikus májbetegeknél, cirrhosisban és hepatocellularis carcinomában szenvedőknél a HCV antitest pozitivitás igen magas, 20–90%. A fertőzés forrása a viraemiás beteg vagy hordozó. Az intravénás kábítószert használók közös tű- és fecskendő használata eredményezi az érintettek magas HCV-prevalenciáját. A fertőzés eredete a betegek 20–50%-ában nem deríthető ki. HCV pozitivitást jelezhet a cryoglobulinaemia is. A HCV pozitív személyek többsége az 1945–1970 között született korosztályban található.
2.1. Rizikócsoportot képeznek
2.1.1. az egészségügyi dolgozók,
2.1.2. az 1993 előtt transzfúzióban részesültek,
2.1.3. a hemodializáltak,
2.1.4. a vérkészítményben részesülők,
2.1.5. a tetováltak, piercinget viselők,
2.1.7. a fertőzöttek szexuális partnerei és
2.1.8. egyes bőrbetegségekben szenvedők (például porphyria cutanea tarda).
A krónikus C-hepatitis spontán remissziója és gyógyulása gyakorlatilag nem fordul elő. A betegek jelentős részénél a krónikus gyulladást (annak aktivitásától függetlenül) fibrosis kíséri. Ennek gyorsasága és mértéke nagy egyéni különbségeket mutat, de ez szabja meg a beteg sorsát. A cirrhosis kialakulása átlag 20–25 év alatt következik be, majd a cirrhosis kialakulása után a betegekben HCC jelentkezik évente 3–5%-os gyakorisággal.
A progressziót gyorsítja a rendszeres alkoholfogyasztás, a haemochromatosis, a társfertőzés egyéb hepatitisvírussal. Az alkoholos cirrhosis HCV fertőzésben az alkohol elhagyása után is progrediálhat. Kompenzált HCV-cirrhosis hirtelen fulmináns dekompenzációját okozhatja akut HAV fertőzés. HIV pozitív betegben az AIDS lefolyását a krónikus C-hepatitis enyhe formája is gyorsítja, valamint HIV fertőzés mellett a hepatitis progressziója is gyorsabb. A progresszió gyorsabb túlsúlyos betegekben (27 feletti testtömeg-index). Szervtranszplantált betegeknél az akut szakasz súlyosabb, majdnem mindig krónikussá válik, és a progresszió rapid. A prognózis összefüggése a HCV vírustiter nagyságával még nem kellően bizonyított.
3.1. Szűrés, rizikócsoportok
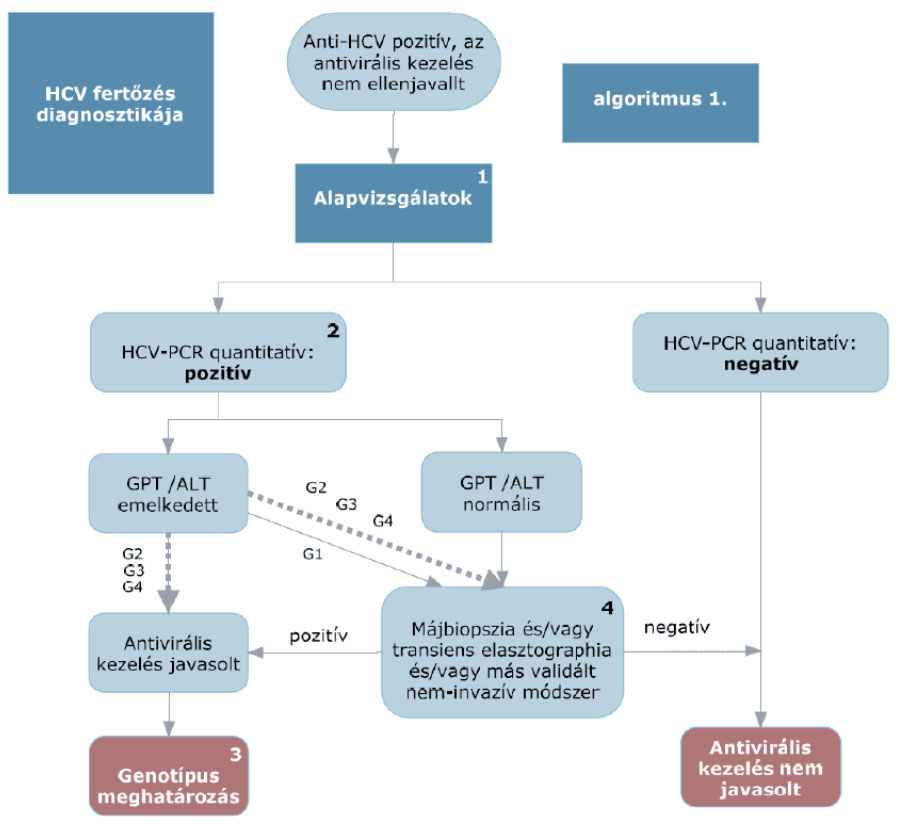
Anti-HCV-vizsgálat szükséges mindazoknál, akiknél májbetegség gyanúja merül fel a klinikum vagy a laboratóriumi, illetve képalkotó vizsgálatok alapján. Szűrendő minden személy, akinél magas a HCV-fertőzés rizikója. Szűrővizsgálatként az anti-HCV 3. generációs enzimimmunoassay (EIA), annak kétes vagy pozitív eredménye esetén ELISA végzendő. Pozitív vagy kétes eredmény esetén HCV RNS PCR-vizsgálat végzése indokolt.
3.2. Diagnózis, indikáció
A hepatitis C vírus diagnózisának feltételei: anti-HCV-ellenanyag és a virális nukleinsav (HCV-RNS), valamint a májkárosodás kimutatása kóros transzaminázok (GPT/ALT) és májbiopszia vagy tranziens elasztográfia (pl. FibroScan vizsgálat), vagy mindkét előbbi ellenjavallata/kivitelezhetetlensége/elérhetetlensége esetén más, validált, nem invazív vizsgálómódszer alapján (például ELF-teszt). Ellenjavallatok hiányában, és ha azt a beteg elfogadja, kimutatható HCV-RNS és biokémiai, szövettani vagy nem invazív módszerrel igazolható, HCV-hez köthető gyulladásos aktivitás vagy fibrosis esetén antivirális kezelés indokolt.
3.2.1. Májbetegség igazolása
Igazolhatóan 6 hónapnál régebben fennálló HCV-fertőzöttség esetén az aktív hepatitis fennállását a kezelés megkezdése előtti egyetlen emelkedett GPT/ALT érték is támogatja, de normál GPT/ALT érték sem zárja azt ki, ha a májgyulladás szövettannal vagy más módszerrel igazolható (aktivitás vagy fibrosis). Megelőző icterus vagy ismert dátumú expozíció után 8–12 hét múlva is perzisztáló HCV-RNS pozitivitás esetén a krónikussá válás valószínűsége nagy, korai antivirális terápia javasolt.
Májbiopszia végzendő, ha azt a kezelőorvos szükségesnek tartja a máj necroinflammatiójának vagy a fibrosis stádiumának meghatározására, differenciáldiagnosztikai vagy prognosztikus céllal vagy a kezelésre vonatkozó döntéshez.
A fibrosis megítélése szempontjából a májbiopsziát tranziens elasztografia (FibroScan) vizsgálat vagy mindkét módszer ellenjavallata/kivitelezhetetlensége/elérhetetlensége esetén más validált nem invazív vizsgálómódszer helyettesítheti (például Shear Wave elasztográfia, ELF-teszt).
Szövettani aktivitás vagy fibrosis jelenléte normális GPT/ALT esetén is indokolja a kezelést, ha annak egyéb feltételei adottak. HCV G2 és G3 genotípusok esetén mellőzhető a májbiopszia és a nem invazív fibrosisvizsgálat.
A májbetegség és a kezelhetőség pontosabb megítéléséhez GOT (AST), GGT, ALP, se. albumin, bilirubin, protrombin, vesefunkciók (kreatinin, eGFR), teljes vérkép és hasi ultrahang- (UH-)vizsgálat (és ha ez alapján vagy emelkedett AFP érték alapján gócos májbetegség/HCC gyanúja merül fel, CT vagy MR vizsgálat) is szükséges.
A terápia előtti (0. heti: a kezelés megkezdése előtt 6 hónapon belül elvégzett), valamint terápia alatti szenzitív kvantitatív HCV-RNS vizsgálatokat valós idejű PCR-technikával, CE-IVD minősítésű, kellő érzékenységű tesztekkel az alábbi módszertani és minőségi feltételeknek megfelelően szükséges végezni:
a) alacsony detekciós limit valamennyi genotípus esetén (±5%): DL≤15 NE/ml;
b) lineáris kvantifikációs tartomány 15NE/ml–108 NE/ml között.
A PegIFN+RBV+PI vagy interferon mentes kezelés megkezdése előtt HCV-genotípus és -szubtípus meghatározása szükséges minden olyan betegnél, akinél a genotípus nem ismert, a HCV-RNS kimutatható, és a beteg kezelése szükségessé válhat.
Olyan anti-HCV-pozitív betegnél, akinél antivirális kezelés biztosan nem végezhető (például kontraindikált vagy a kezelést a beteg dokumentáltan nem vállalja), HCV-RNS és genotípus meghatározása nem indokolt.
4. A kezelések engedélyezése
Kezelési engedély csak az erre a célra létrehozott Hepatitis Regiszter (HepReg) rendszerben elektronikusan benyújtott kérelmek alapján adható ki.
A kezelések engedélyezéséről az NEAK dönt a Hepatitis Terápiás Bizottság javaslata, valamint a kezelési kérvény Prioritási Indexe alapján, a rendelkezésre álló költségvetési források, illetve a mindenkor rendelkezésre álló gyógyszer-keretek figyelembevételével.
4.1. Prioritási Index definíciója, célja
4.1.1. A Prioritási Index a májfibrosis mértékén alapuló, a májkárosodás súlyosságát és szövődményeit, a betegség aktivitását, progresszióját, az átvitel veszélyét, és további meghatározott speciális szempontokat is figyelembe vevő, a HCV-fertőzött betegek kezelésbe vonásának szakmailag indokolt sorrendjét meghatározó numerikus érték, amelynek célja, hogy orientálja a kezelőorvosokat a kezelésre szorulók ütemezését illetően, mind a kérvények benyújtásakor, mind pedig az engedélyezett kezelések megkezdésekor.
4.1.2. Objektív komponensei:
4.1.2.1. a májbetegség/fibrosis/Child-Pugh stádiuma,
4.1.2.2. a májbetegség aktivitása,
4.1.2.3. a májbetegség progressziójának üteme.
4.1.3. Szubjektív komponensei:
4.1.3.1. a kezelőorvos megítélése szerinti prioritási pontok,
4.1.3.2. a Hepatitis Terápiás Bizottság által adható prioritási pontok.
4.1.4. Speciális szempontok:
4.1.4.1. szervtranszplantált/transzplantációra váró betegek,
4.1.4.2. hemophiliás/vérzékeny betegek kezelési prioritását reprezentáló pontok (ekkor csak eredménytelen/elérhetetlen nem-invazív vizsgáló módszer esetén adható),
4.1.4.3. foglalkozással, foglalkoztathatósággal, gyermekvállalással és egyéb speciális szemponttal összefüggő pontok,
4.1.4.4. interferon mentes kezelésekhez kapcsoló speciális pontok.
4.2. Prioritási Index számítása
A Prioritási Index az alábbi pontok alatt felsorolt paraméterekhez tartozó pontszámok numerikus összege:
4.2.1. Stádium szövettan, FibroScan vagy más non-inazív teszt alapján (maximum 70 pont)
4.2.1.1. A májbiopsziát (szövettant) FibroScan helyettesítheti, vagy mindkettő ellenjavallata/kivitelezhetetlensége/
elérhetetlensége esetén más validált nem-invazív vizsgáló módszer (pl. FibroTest, ELF teszt) helyettesítheti
4.2.1.2. Metavir/Knodell/FibroScan/FibroTest/Shear Wave elasztográfia/ELF teszt F0–F4 szerint 0–4×10 pont (maximum 40 pont)
4.2.1.2.1. Átmenetek: F0/F1, F1/F2, F2/F3, F3/F4 esetén sorrendben 5-15-25-35 pont
4.2.1.3. Ishak fibrosis score értékelése: 1: 10 pont, 2: 15 pont, 3: 20 pont, 4: 30 pont, 5: 35 pont, 6: 40 pont
4.2.1.4. Ha egyik vizsgálat eredménye sem áll rendelkezésre, akkor 10 pont
4.2.1.5. Plusz pontok előrehaladott cirrhosis miatt liver stiffness alapján Child A stádiumú betegnél (maximum 30 pont)
4.2.1.5.1. Fibroscan eredmény 18,0–32,9 kPa között 5 kPa-onként +5 pont
4.2.1.5.2. Fibroscan eredmény 32,9 kPa felett 10 kPa-onként +5 pont
4.2.1.6. Child-Pugh B vagy C stádium: 70 pont
4.2.2. Aktivitás, progresszió üteme (maximum 8 pont)
4.2.2.1. Az alábbiak közül a nagyobbik (maximum 4 pont)
4.2.2.1.1. HAI vagy Ishak aktivitás: 3–6 = 1 pont, 7–9 = 2 pont, 10–12 = 3 pont, 13-tól = 4 pont
4.2.2.1.2. METAVIR aktivitás: A1 = 1 pont, A2 = 2 pont, A3 = 3 pont, A4 = 4 pont
4.2.2.1.3. Progresszió elasztográfia alapján: ∆1–1,99 kPa = 1 pont, ∆2–2,99 kPa = 2 pont, ∆3 kPa = 4 pont
4.2.2.1.4. Progresszió szövettannal (∆F stádium) ∆F1 = 1 pont, ∆F2 = 2 pont, ∆F3 = 3 pont, ∆F4 = 4 pont
4.2.2.2. Utolsó GPT (NE/ml) érték/50 = pontszám (maximum 4 pont)
4.2.3.1. Transzplantáció miatti plusz pontok (bármely szerv transzplantációja esetén):
4.2.3.1.1. Transzplantációs listán lévő vagy HCV-fertőzöttség miatt transzplantációs programból kizárt beteg: 50 pont
4.2.3.1.2. Élő donoros transzplantációra váró beteg: 20 pont
4.2.3.1.3. Transzplantáción átesett beteg, fibrosis stádiumtól függetlenül: 50 pont
4.2.3.1.4. Transzplantáción átesett betegben fibrotizáló cholestaticus hepatitis: 80 pont
4.2.3.1.5. Haemophíliás beteg: 20 pont
4.2.3.1.6. Dializált beteg (hemodialízis vagy peritoneális dialízis): 20 pont
4.2.3.1.7. Különleges egyéb epidemiológiai indok (indoklással, pl. intézeti elhelyezés): 10 pont
4.2.3.1.8. In vitro fertilitási programban részt vevő beteg: 50 pont
4.2.3.1.9. HCV eradikálása után gyermeket vállalni szándékozó 30 év feletti gyermektelen nőbeteg: 20 pont (a kezelésre szoruló nyilatkozatát csatolni szükséges)
4.2.3.1.10. Súlyos extrahepatikus HCV manifestatio (pl. cryoglobulinaemias vasculitis, glomerulonephritis, súlyos polyarthritis, porphyria cutanea tarda, lichen ruber planus): 20 pont
4.2.3.1.11. HCV-fertőzöttség miatt foglalkozása gyakorlásától jogszabályban eltiltott személy: 50 pont
4.2.3.1.12. Betegellátásban vagy humán minták kezelésében aktívan részt vevő személy: 30 pont
4.2.3.1.13. Minden további korábbi vagy jelenlegi egészségügyi dolgozó: 15 pont
4.2.3.1.14. HCV asszociált non-Hodgkin lymphoma: 50 pont
4.2.3.1.15. Hepatocellularis carcinoma (HCC) sikeres sebészi vagy ablációs kezelésén átesett, onkoteam alapján tumormentesnek tekinthető beteg: 50 pont
4.2.3.1.16. HIV vagy HBV koinfectio: 20 pont
4.2.4. Interferon mentes kezelésekhez kapcsolódó speciális pontok
4.2.4.1. Thrombocyta 70–89 G/L esetén: 5 pont
4.2.4.2. Thrombocyta <70 G/L esetén: 10 pont
4.2.4.3. Szérum albumin 30–34 g/L esetén: 5 pont
4.2.4.4. Szérum albumin <30 g/L esetén: 10 pont
4.2.4.5. Esophagus varicositas G1–2 esetén: 5 pont
4.2.4.6. Esophagus varicositas >G2 esetén: 10 pont
4.2.4.7. Korábban Child-Pugh B vagy C stádium vagy varixvérzés esetén: 15 pont
4.2.5. Automatikusan nem értékelhető egyéb szempontok (maximum 12 pont)
4.2.5.1. Kezelőorvos pontja: maximum 2 pont (indoklás szükséges)
4.2.5.2. Hepatitis Terápiás Bizottság pontja: maximum 10 pont (indoklás szükséges)
4.2.6. A Prioritási Index a kezelésre várakozás alatt (az ezirányú kérvény benyújtását követően havonta 1 ponttal növekszik).
Valamennyi naiv-nak minősülő, kezelésben korábban nem részesült beteg kezelését PR kettős kombinációval kell megkezdeni, ha nincs ellenjavallat.
Az interferon alapú kezelések alatti víruskinetika protokoll szerinti követése, és a STOP-szabályok maradéktalan betartása kiemelt fontosságú.
A kezelés során laboratóriumi monitorozás szükséges: bármely kezelés megkezdését követően az első 4 hétben kéthetente, majd négyhetenként teljes vérkép, négyhetenként GPT/ALT, GOT/AST, se. bilirubin, 12 hetenként se. kreatinin, vércukor, TSH, húgysav meghatározása.
Az interferon mentes terápiák kizárólag azon betegek esetében alkalmazhatók, akiknél,
a) az interferon alapú kezelés kontraindikált;
b) a megelőző interferon alapú kezelés sikertelen volt;
c) a megelőző interferon alapú kezelés súlyos mellékhatások miatt megszakításra került;
d) F4-es stádiumú fibrosis, FS >20 kPa fennállása esetén;
e) az IFN-mentességre jogosultságot megalapozó egyéb szakmai vagy méltányolást indokoló körülmény áll fenn, pl.
ea) örökletes súlyos vérzékenységben szenvedő személy,
eb) májrák (HCC) sikeres sebészi vagy ablációs kezelésén átesett, onkológus véleménye alapján tumormentesnek tekinthető beteg,
ec) szervtranszplantáción átesett beteg,
ed) dializált beteg (hemodialízis vagy peritoneális dialízis),
ee) abszolút vagy relatív INF ellenjavallatot jelentő súlyos extrahepatikus HCV manifestatio/társulás jelenléte (pl. cryoglobulinaemias vasculitis, glomerulonephritis, súlyos polyarthritis, porphyria cutanea tarda, lichen ruber planus),
ef) HCV asszociált non-Hodgkin lymphomás vagy e miatt kezelt beteg,
eh) HCV-fertőzöttség miatt foglalkozása gyakorlásától jogszabályban eltiltott személy,
ei) aktív betegellátásban vagy humán minták kezelésében részt vevő személy.
A NEAK a szakmai igények figyelembe vételével dönt arról, hogy a rendelkezésére álló költségvetési forrásokat miként osztja el az egyes terápiás lehetőségek között. Ennek következtében előfordulhat, hogy egy adott időszakban a jelen finanszírozási eljárásrendben szereplő terápiák nem mindegyike érhető el a klinikai gyakorlatban.
Tartós vírusválasz (SVR) megítélésére a HCV-RNS negatívvá vált betegeknél a kezelés befejezése után 24 héttel HCV-RNS vizsgálat szükséges.
Bármely STOP-szabály hatálya alá eső beteg számára csak a korábbinál igazoltan hatékonyabb gyógyszeres kezelés rendelhető.
A kezelés előtt vagy alatt – fogékonyság esetén – hepatitis A és hepatitis B ellen vakcináció javasolt.
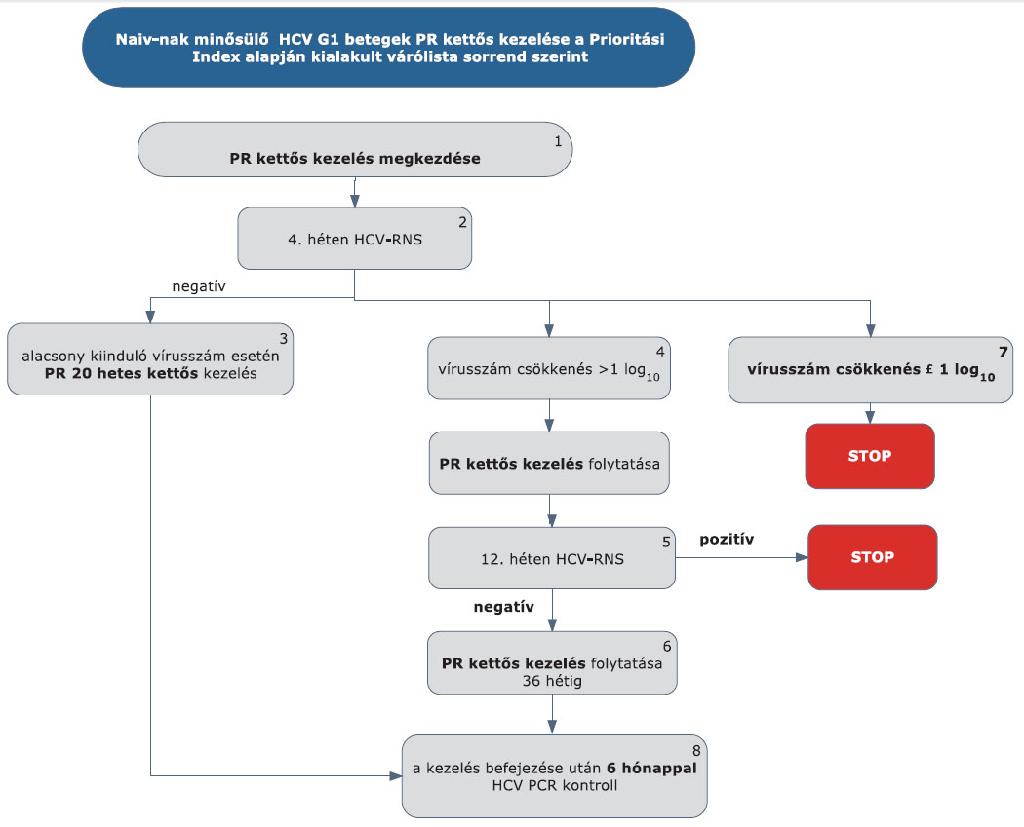
5.1. Pegilált interferon + ribavirin kettős kezelés (PR)
5.1.1. A PegIFN és ribavirin adagolását, valamint a mellékhatás miatti dóziscsökkentésre vonatkozó szabályokat a készítmények alkalmazási előírásai ismertetik.
A két különböző PegIFN egymással történő helyettesíthetőségével kapcsolatban nem állnak rendelkezésre adatok, ezért nem ajánlott.
5.1.2. Az algoritmus részletezése
5.1.2.1. A kezelés 4. hetét követően HCV-RNS vizsgálatot kell végezni.
5.1.2.2. Ha a 4. héten a HCV-RNS nem mutatható ki (negatív), a kettős kezelést kell tovább folytatni. Alacsony kiinduló vírus titerszám esetén (<400 000 IU/ml), ha nem áll fenn cirrhosis, 24 hetes PR kettős kezelés elegendő.
5.1.2.3. Ha a 4. héten végzett HCV PCR alapján a kiinduló vírusszám csökkenése nagyobb, mint 1 log10, a PR kettős kezelést tovább kell folytatni.
5.1.2.4. A kezelés 12. hetét követően HCV-RNS vizsgálatot kell végezni. Ha ekkor a HCV-RNS kimutatható (pozitív), a PR kettős kezelést le kell állítani STOP-szabály alapján. Ha a kezelés 12. hetében HCV-RNS nem mutatható ki (negatív), PR kettős kezelést kell tovább folytatni még 12 vagy 36 héten át. A kezelés időtartama összesen 48 hét.
5.1.2.5. HCV G2- vagy HCV G3-monoinfekcio eseten a naiv-nak minősülő betegek PR kettős kezelésének időtartama 24 hét, az alábbi kivételekkel:
a) ha a kezelés megkezdését megelőzően végzett PCR-vizsgálat alacsony kiinduló vírusszintet igazol (HCV-RNS ≤800 000 NE/ml) és a HCV-RNS 4 hét kezelés után nem mutatható ki, a G2-betegekben a kettős kezelés 16 hétig tart,
b) ha a HCV-RNS 4 hét PegIFN+RBV kettős kezelés után kimutatható, a terápia meghosszabbítása indokolt 48 hétre.
5.1.2.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.2. Pegilált interferon + ribavirin + proteáz-gátló (PI) hármas kezelés (PRP)
5.2.1. A proteáz-gátlók (PI) orálisan adható, a HCV G1 genotípus ellen direkt antivirális hatással rendelkező készítmények.
5.2.2. PegIFN vagy RBV vagy PI ellenjavallata, vagy intolerancia kialakulása esetén PRP hármas kezelés nem végezhető.
5.2.3. RBV nélküli PegIFN terápia kombinálása PI kezeléssel rezisztencia kialakulása miatt tilos.
5.2.4. PRP hármas kezeléskor a kétféle PegIFN készítmény (2a, illetve 2b) bármelyike alkalmazható, dózisuk és a ribavirin dózisa megfelel az előzőekben leírtaknak.
5.2.5. PRP hármas kezeléskor a háromféle PI készítmény (boceprevir, illetve simeprevir/telaprevir) bármelyike alkalmazható, de az alkalmazás módja, ideje, a rendelkezésre álló evidenciák és a mellékhatások különbözősége befolyásolhatja az egyes betegeknél a PI választást:
5.2.5.1. boceprevir alapú hármas kezelés javasolható olyan betegeknél, akiknél nagy az esélye, hogy hatástalanság miatt a PRP hármas kezelést az első 12 héten belül be kell fejezni. Ilyen betegek lehetnek például a korábbi PR kezelés során null-reagáló cirrhosisos betegek,
5.2.5.2. korábbi PR kettős kezelés után relabáló nem-cirrhotikus betegek számára – a rövidebb kezelés lehetősége miatt – költséghatékonysági szempontból a simeprevir/telaprevir látszik célszerűbbnek,
5.2.5.3. mellékhatás esetén a PI-ok dózisának csökkentése nem javasolt; a PegIFN vagy a ribavirin dózisának csökkentése vagy a PI teljes elhagyása vagy mindhárom készítmény elhagyása mérlegelendő.
5.3. Hármas kezelési (PRP) algoritmusok
5.3.1. HCV G1 betegek PR + boceprevir alapú hármas kezelése
5.3.1.1. A készítmény adagolását, valamint a mellékhatások gyakoriságát a készítmény alkalmazási előírása ismerteti.
5.3.1.2. Lead-in periódus
A boceprevir alapú hármas kezelés minden esetben 4 hetes bevezető (lead-in) PR kettős kezeléssel kezdődik. A kezelési hetek számolása minden esetben a lead-in periódus kezdetétől indul.
5.3.1.3. Ha a betegnél nem áll fenn cirrhosis, és kezelésben még nem részesült (naiv-beteg), úgy a 4 hetes PR lead-in kezelés után további 24 hétig folytatandó a PR + boceprevir hármas kezelés. A kezelés teljes időtartama 28 hét.
5.3.1.4. Ha a beteg nem cirrhosisos, de részesült már kezelésben, akkor a lead-in-t követően 32 hétig folytatandó a PR + boceprevir hármas kezelés. A kezelés teljes időtartama 36 hét.
5.3.1.5. Minden cirrhosisos betegnél a 4 hetes lead-in kettős kezelés után további 44 héten át kell folytatni a PR + boceprevir hármas kezelést. A kezelés teljes időtartama 48 hét. Ha a beteg nem tolerálja a hármas kezelést, az utolsó 12 héten PR kettős kezelést kaphat.
5.3.1.6. A boceprevir alapú hármas kezelés virológiai követése, STOP-szabályok
A boceprevir alapú kezelés abbahagyandó (mindegyik készítmény), ha
a) a HCV-RNS 8 hét kezelés után kimutatható vagy
b) a HCV-RNS 12 hét kezelés után kimutatható vagy
c) a HCV-RNS 24 hét kezelés után kimutatható.
5.3.1.7. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.3.2. HCV G1-betegek PR + telaprevir alapú hármas kezelése
5.3.2.1. A készítmény adagolását, a mellékhatások gyakoriságát az alkalmazási előírás ismerteti.
5.3.2.2. Lead-in periódus alkalmazása nem szükséges, a kezelési hetek számolása minden esetben a telaprevir kezelés megkezdésétől indul.
5.3.2.3. Ha a betegnél nem áll fenn cirrhosis, illetve a kiterjesztett vírusválasz (eRVR) pozitív, 12 hetes PR + telaprevir kezelést követően még további 12 héten át PR kettős kezelés szükséges.
5.3.2.4. Minden cirrhosisos betegnél, vagy akiknél az eRVR negatív, a 12 hetes PR + telaprevir hármas kezelést 36 hétig tartó PR kettős kezelés zárja le.
5.3.2.5. A telaprevir alapú hármas kezelés virológiai követése, STOP-szabályok
A telaprevir alapú kezelés abbahagyandó (mindegyik készítmény), ha
a) a HCV-RNS 4 hét kezelés után >1000 IU/ml vagy
b) a HCV-RNS 12 hét kezelés után >1000 IU/ml vagy
c) a HCV-RNS 24 hét kezelés után is >15 IU/ml.
5.3.2.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.3.3. HCV G1- vagy G4-betegek PR + simeprevir alapú hármas kezelése
5.3.3.1. A készítmény adagolását, a mellékhatások gyakoriságát az alkalmazási előírás ismerteti.
5.3.3.2. Lead-in periódus alkalmazása nem szükséges, a kezelési hetek számolása minden esetben a simeprevir kezelés megkezdésétől indul.
5.3.3.3. A betegek PR + simeprevir hármas kombinációs kezelése 12 hétig tart. Ha a betegnél nem áll fenn cirrhosis, korábban nem részesült kezelésben vagy részesült, de relabált, akkor a PR + simeprevir kezelést további 12 hétig kettős kezelés követi. A kezelés teljes időtartama 24 hét.
5.3.3.4. Ha a beteg cirrhotikus vagy a korábbi PR kezelésre null-reagáló volt, akkor a PR + simeprevir kezelést követően 24 hétig kell a PR kezelést folytatni. A kezelés teljes időtartama 48 hét.
5.3.3.5. A simeprevir alapú hármas kezelés virológiai követése, STOP-szabályok
A simeprevir alapú kezelés abbahagyandó (mindegyik készítmény), ha
a) a HCV-RNS 4 hét kezelés után >25 IU/ml vagy
b) a HCV-RNS 12 hét kezelés után kimutatható (PCR pozitív) vagy
c) a HCV-RNS 24 hét kezelés után kimutatható (PCR pozitív).
5.3.3.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.3.4. HCV G1-, G3–6-betegek PR + sofosbuvir alapú hármas kezelése
5.3.4.1. A készítmény adagolását, a mellékhatások gyakoriságát az alkalmazási előírás ismerteti.
5.3.4.2. A betegek PR + sofosbuvir hármas kombinációs kezelése 12 hétig tart. Negatív prediktorok fennállása esetén megfontolandó a 24 hetes terápia.
5.3.4.3. A sofosbuvir alapú hármas kezelés során nincsen STOP-szabály, ezért kezelés közben a HCV-RNS-szint monitorozása nem szükséges.
5.3.4.4. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.4. Interferon mentes terápiák
Az interferon mentes terápiák kizárólag azon betegek esetében alkalmazhatók, akiknél
a) az interferon alapú kezelés kontraindikált;
b) a megelőző interferon alapú kezelés sikertelen volt;
c) a megelőző interferon alapú kezelés súlyos mellékhatások miatt megszakításra került;
d) F4-es stádiumú fibrosis, FS >20 kPa fennállása esetén;
e) az IFN-mentességre jogosultságot megalapozó egyéb szakmai vagy méltányolást indokoló körülmény áll fenn, pl.
ea) örökletes súlyos vérzékenységben szenvedő személy,
eb) májrák (HCC) sikeres sebészi vagy ablációs kezelésén átesett, onkológus véleménye alapján tumormentesnek tekinthető beteg,
ec) szervtranszplantáción átesett beteg,
ed) dializált beteg (hemodialízis vagy peritoneális dialízis),
ee) abszolút vagy relatív INF ellenjavallatot jelentő súlyos extrahepatikus HCV manifestatio/társulás jelenléte (pl. cryoglobulinaemias vasculitis, glomerulonephritis, súlyos polyarthritis, porphyria cutanea tarda, lichen ruber planus),
ef) HCV asszociált non-Hodgkin lymphomás vagy e miatt kezelt beteg,
eh) HCV-fertőzöttség miatt foglalkozásuk gyakorlásától jogszabályban eltiltott személy,
ei) aktív betegellátásban vagy humán minták kezelésében részt vevő személy.
Valamennyi, interferon mentes terápia megkezdése előtt a genotípus meghatározása kötelező.
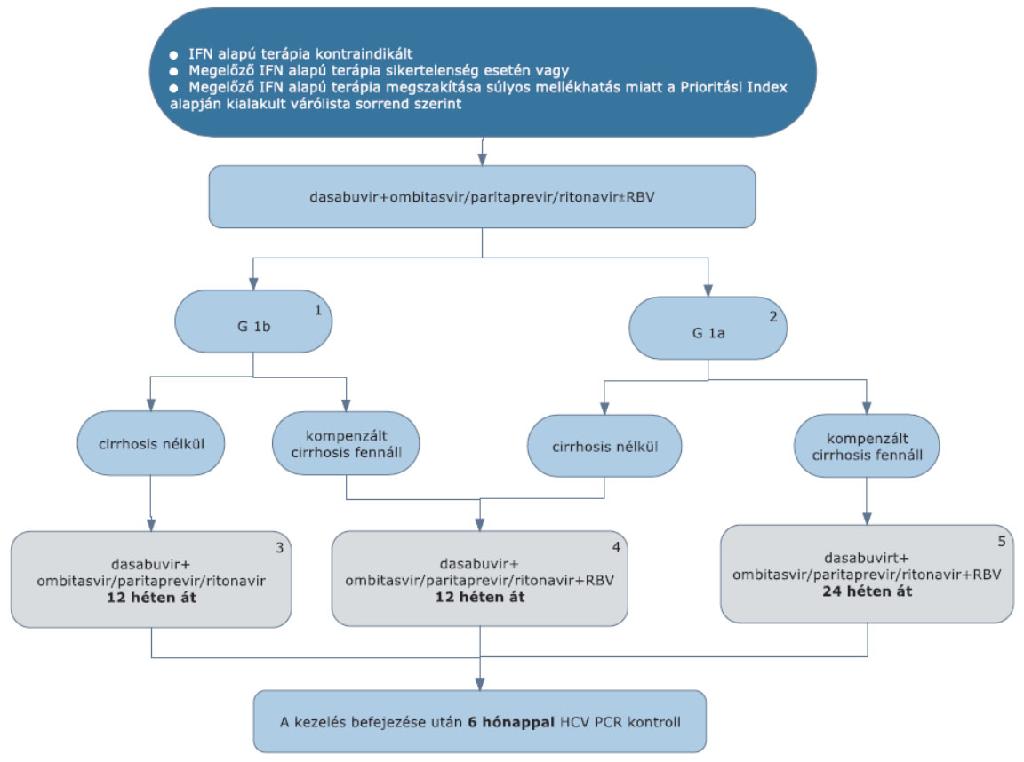
5.4.1. Dasabuvir + ombitasvir/paritaprevir/ritonavir (ABT3D) + ribavirin kombinációs kezelés
5.4.1.1. A dasabuvir+ombitasvir/paritaprevir/ritonavir (ABT3D) + ribavirin kombinációs kezelés 1a és 1b genotípus esetén alkalmazható, kompenzált cirrhosis fennállása esetén vagy cirrhosis nélküli betegeknek, beleértve a HIV társfertőzötteket, a végstádiumú vesebetegeket és a dializáltakat is (eGFR <30 ml/min).
5.4.1.2. 1b genotípus esetén (1), ha cirrhosis nem áll fenn, az ABT3D kombináció ribavirin nélkül adható. A kezelés időtartama 12 hét. (3)
5.4.1.3. 1b genotípus esetén, ha kompenzált cirrhosis fennáll, ABT3D + ribavirin kombinációs kezelés adható. A kezelés időtartama 12 hét. (4)
5.4.1.4. 1a genotípus esetén (2), ha cirrhosis nem áll fenn, ABT3D + ribavirin kombinációs kezelés adható. A kezelés időtartama 12 hét. (4)
5.4.1.5. 1a genotípus esetén, ha kompenzált cirrhosis fennáll, ABT3D + ribavirin kombinációs kezelés adható. A kezelés időtartama 24 hét. (5)
5.4.1.6. Szervtranszplantáltaknál, ABT3D + ribavirin kombinációs kezelés adható. A kezelés időtartama 24 hét.
5.4.1.7. G4-beteg esetében Paritaprevir/ritonavir + ombitasvir (ABT2D) + RBV kombináció javasolt, korábban nem kezelt, nem cirrhosisos betegek kezelésére. A kezelés időtartama cirrhosis nélkül 12 hét, kompenzált cirrhosisos betegeknél 24 hét.
5.4.1.8. Vesebetegek esetében <30 ml/min eGFR esetén is adható, beleértve a dializált betegeket is.
5.4.1.9. Az ABT3D/ABT2D kombinációval végzett kezelés során nincsen STOP-szabály, ezért kezelés közben a HCV-RNS-szint monitorozása nem szükséges.
5.4.1.10. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.4.2. Ledipasvir + sofosbuvir ± ribavirin kombinációs kezelés
A ledipasvir (LDV) a sofosbuvirral (SOF) fix dózisú kombinációban törzskönyvezett készítmény.
5.4.2.1. Cirrhosisban nem szenvedő G1-, G4-, G5- vagy G6-fertőzött betegeknél a kezelés időtartama 12 hét, ribavirin nélkül.
5.4.2.2. 8 hetes kezelés javasolt cirrhosisban nem szenvedő, G1 genotípusú vírussal fertőzött, korábban nem kezelt olyan betegeknél, akiknél 6 millió NE/ml alatti a kiinduló vírusszám (kivéve a szervtranszplantáción átesetteket).
5.4.2.3. Kompenzált vagy dekompenzált cirrhosisban szenvedő, vagy korábban PegIFN+RBV-nel sikertelenül kezelt G1- vagy G4-fertőzött betegeknél a kezelés kiegészítése szükséges RBV-vel. A kezelés időtartama 12 hét. Ribavirin ellenjavallat vagy intolerancia esetén a kezelési idő 24 hét.
5.4.2.4. G3 genotípussal fertőzött cirrhosisban szenvedő betegeknél a kezelés RBV-vel egészítendő ki. A kezelés időtartama 24 hét.
5.4.2.5. Az LDV+SOF kombinációval végzett kezelés során nincsen STOP-szabály, ezért kezelés közben a HCV-RNS-szint monitorozása nem szükséges.
5.4.2.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.4.3. Elbasvir + grazoprevir ± ribavirin kombinációs kezelés
Az elbasvir + grazoprevir kombinációs kezelés 1a, 1b és 4-es genotípus esetén alkalmazható. HIV társfertőzés esetén és végstádiumú vesebetegek esetében <30 ml/min eGFR esetén is adható, beleértve a dializált betegeket is.
5.4.3.1. 1b genotípus esetén a kezelés időtartama 12 hét, ribavirin nélkül. Ha a beteget korábban sikertelenül kezelték PI kezeléssel, akkor ribavirinnel kombinálva adandó.
5.4.3.2. 1a és G4 genotípus esetén az elbasvir/grazoprevir + ribavirin kezelés időtartama 16 hét.
5.4.3.3. Az elbasvir + grazoprevir kombinációval végzett kezelés során nincsen STOP-szabály, ezért a HCV-RNS-szint monitorozása nem szükséges.
5.4.3.4. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.4.4. Daclatasvir + simeprevir ± ribavirin kombinációs kezelés
A daclatasvir + simeprevir kombinációs kezelés 1b genotípus esetén mérlegelendő.
5.4.4.1. A kezelés megkezdése előtt polimorfizmus vizsgálata indokolt. NS5A-L31 vagy NS5A-Y93 RAV küszöbérték (10%) feletti jelenléte esetén a kombináció nem adható.
5.4.4.2. Naiv-nak minősülő G1b-betegek kezelésének időtartama 24 hét, RBV nélkül.
5.4.4.3. PR kettős kezelésre nem reagáló betegek kezelésének időtartama 24 hét, RBV együttes adása szükséges.
5.4.4.4. A daclatasvir + simeprevir kombinációval végzett kezelés során nincsen STOP-szabály, ezért a HCV-RNS-szint monitorozása nem szükséges.
5.4.4.5. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.4.5. Daclatasvir + sofosbuvir ± ribavirin kombinációs kezelés
A daclatasvir + sofosbuvir G1, G3 vagy G4 genotípussal fertőzött betegeknek adható.
5.4.5.1. G1- vagy G4-fertőzött nem cirrhosisos betegekben a kezelés időtartama 12 hét, kompenzált cirrhosisos betegekben 24 hét, ribavirin együttes adása nem szükséges.
5.4.5.2. Korábbi PI kezelésre nem reagáló betegeknél a kezelés időtartamának meghosszabbítása mérlegelendő 24 hétre, ribavirin együttes adása nem szükséges.
5.4.5.3. G3 genotípus esetén kompenzált cirrhosisos vagy korábban PI-kezelésben részesült betegek esetében a kezelés időtartama 24 hét, ribavirinnel kombinálva.
5.4.5.4. A daclatasvir + sofosbuvir kombinációval végzett kezelés során nincsen STOP-szabály, ezért a HCV-RNS-szint monitorozása nem szükséges.
5.4.5.5. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.4.6. Sofosbuvir + simeprevir ± ribavirin kombinációs kezelés
5.4.6.1. A sofosbuvir + simeprevir G1 vagy G4 genotípussal fertőzött betegeknek adható.
Korábban nem kezelt vagy korábbi PR kettős kezeléssel sikertelenül kezelt cirrhosisos vagy nem cirrhosisos betegeknél a kezelés időtartama egyaránt 12 hét ribavirin adása mellett.
5.4.6.2. G1-fertőzött betegek kezelésekor ribavirin adása nem szükséges, de G1a vagy kedvezőtlen prediktorok (beleértve a PR kezelésre null-reagáló betegeket) esetén adása indokolt lehet.
5.4.6.3. PRP kezelés során meg nem gyógyult betegeknél, a SOF+SMV+RBV kezelés hatékonysága a PI-rezisztencia miatt további vizsgálatokat igényel.
5.4.6.4. A sofosbuvir + simeprevir kombinációval végzett kezelés során nincsen STOP-szabály, ezért a HCV-RNS-szint monitorozása nem szükséges.
5.4.6.5. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.4.7. Sofosbuvir + ribavirin kombinációs kezelés
Terápia-naiv-nak minősülő vagy PR kettős kezeléssel sikertelenül kezelt HCV G2-vel fertőzött kompenzált vagy dekompenzált cirrhosisos vagy nem cirrhosisos beteg: 12 hetes Sofosbuvir + ribavirin kezelés.
Megfontolandó a terápia időtartamának legfeljebb 24 hétre történő meghosszabbítása, ha több olyan tényező áll fenn, amely a korábbiakban az interferon alapú terápiákkal szembeni alacsonyabb válaszarányokkal járt együtt (például előrehaladott fibrosis/cirrhosis, magas kiindulási vírustiter, fekete rassz, IL28B, nem CC genotípus, a terápiás válasz hiánya a korábbi peginterferon alfa és ribavirin kezelés során).
Megelőző icterus vagy ismert dátumú expozíció után 8–12 hét múlva is perzisztáló HCV-RNS-pozitivitás esetén korai antivirális kezelés indokolt, 24 hetes PegIFN-monoterápiával. A kezelés 4. hetét követően is kimutatható HCV-RNS esetén a kezelés kiegészítése javasolt RBV-vel.
6.2. HCV-fertőzött várandósok és kismamák
HCV-fertőzött várandósok és kismamák kezelése a terhesség és szoptatás utánra halasztandó. HCV-fertőzött anyáknál az elektív császármetszés nem véd a HCV-fertőzés átvitele ellen, ezért preventív császármetszés nem indokolt.
Szoptatással történő transzmisszióra nincs evidencia, ezért a HCV-fertőzött kismama szoptathat. Ugyanakkor a szoptatás felfüggesztése megfontolandó, ha a mellbimbó bereped, illetve vérzik.
HCV-fertőzött anya gyermekénél a szűrés 18 hónapos korban javasolt.
Hároméves kor felett indokolt esetben gyermekgyógyász és hepatológus együttes javaslata alapján 48 hetes PR kettős kezelés javasolható. Dozírozás az alkalmazási előírás szerint. 18 éves kor alatt PI alkalmazása tapasztalat hiányában nem megengedett.
6.4. Extrahepaticus manifesztációk
Az extrahepaticus manifesztációk közül egyértelmű kezelési prioritást élvez a cryoglobulinaemiás vasculitis, a glomerulonephritis, a súlyos polyarthritis, a porphyria cutanea tarda, a lichen ruber planus és a non-Hodgkin lymphoma (NHL).
NHL esetén hematológus és hepatológus együttes véleménye alapján dönthető el, hogy melyik betegség kezelése történjen elsőként.
6.5. Pozitív addiktológiai anamnézisű és pszichiátriai betegek
A kábítószer-használók körében világszerte növekszik a HCV-fertőzöttek száma. Kábítószert jelenleg vagy a közelmúltban használó személy esetén az addiktológus véleményét figyelembe véve mérlegelhető kezelés.
Ha kábítószer használatára pozitív az anamnézis, akkor a kombinált antivirális kezelés 3 hónapos – legalább két negatív drogteszttel igazolt – absztinencia után kezdhető meg.
A DAA készítmények megválasztásakor a gyógyszer-interakciók figyelembevétele szükséges.
IFN-kezelés megkezdése előtt a manifeszt pszichiátriai zavar (különös tekintettel a depresszióra és a szorongásos kórképekre) kizárása szükséges, pszichiátriai javaslattal, szoros pszichiátriai ellenőrzés mellett kezdhető meg a kezelés.
6.6. HCV-HBV társfertőzés
A HCV kezelése alatt vagy után a HBV-infekció fellángolhat, emiatt szoros monitorozás indokolt.
A HBV-társfertőzött CHC-s betegeket a HCV-monoinfekció szabályai szerint kell kezelni.
6.7. HIV-HCV társfertőzés
Aktív retrovirális kezelés, illetve <200/μl CD4 sejtszám esetén fokozott ellenőrzés indokolt a tejsavacidosis, illetve a cytopenia lehetősége miatt.
IFN-mentes kezelés a HIV-társfertőzés nélküli HCV-nek megfelelően végezhető.
A kezelés indikációja megegyezik a haemoglobinopathiában nem szenvedő HCV-fertőzöttekével. A jelentős anaemizálódási hajlam miatt IFN- és RBV-mentes kezelés előnyben részesítendő.
6.9. Krónikus veseelégtelenség
Krónikus vesebetegeknél a kezelési mód megválasztása a szérumkreatinin-szinttől és a kreatininclearancetől vagy a becsült glomeruláris filtrációs rátától (eGFR) függ.
Peg-IFN-alfa-2a+RBV kombinált kezelés – megfelelő monitorozás mellett, dóziscsökkentéssel – beszűkült vesefunkciók esetén is végezhető.
Peg-IFN-alfa-2b+RBV 200 μmol/l feletti kreatinin vagy 50 ml/perc alatti kreatininclearance esetén ellenjavallt. Peg-IFN-alfa-2b-monoterápia végezhető beszűkült vesefunkció esetén (15–50 ml/perc kreatininclearance) az alkalmazási előírásban rögzített dóziscsökkentéssel.
Enyhe és középsúlyos veseelégtelenségben a SOF+LDV kombináció biztonsággal adható.
Az ABT3D±RBV kombinációval kevés, de biztató adat áll rendelkezésre; előrehaladott vesebetegségben is biztonságosnak tűnik.
A grazoprevir + elbasvir kombinációt hatékonynak és biztonságosnak találták előrehaladott vesebetegségben is – ribavirin adása nélkül.
A ribavirin – ha szükséges – csökkentett dózisban adható (napi 1×200 mg vagy heti 3×200 mg). Kifejezett óvatosságra van szükség.
Hemodializált betegek kombinált antivirális kezelése egyedi mérlegelés alapján elsősorban akkor indokolt, ha a beteg vesetranszplantációra is esélyes.
6.10. Szervtranszplantáció (kivéve májátültetés)
Szervtranszplantáció (kivéve májátültetés) után csak IFN-mentes kombináció adása javasolható; a kezelés mindenképpen indokolt és prioritást élvez.
Az esetleges gyógyszerinterakciók körültekintő értékelésével egyedi mérlegelés szükséges. SOF, LDV vagy DCV esetén sem a tacrolimus, sem a cyclosporin A adagjának módosítása nem szükséges. SIM és cyclosporin A együtt adása nem javasolható.
Szervtranszplantáltak HCV kezelése olyan intézményben végzendő, ahol az immunszuppresszív szerek (cyclosporin, tacrolimus) koncentrációját egyidejűleg monitorozni lehet.
6.11. Májtranszplantáltak (Májtranszplantáció utáni HCV rekurrencia kezelése)
Májtranszplantált betegeknél kialakuló új HCV-fertőzés (vagy rekurrencia) a rejekció lehetőségének kizárását követően korán kezelendő, mindenképpen indokolt és prioritást élvez.
A DAA készítmények potenciális interakciói fokozott figyelmet igényelnek.
Májtranszplantáltak HCV kezelése olyan intézményben végzendő, ahol az immunszuppresszív szerek (cyclosporin, tacrolimus) koncentrációját egyidejűleg monitorozni lehet.
7. A finanszírozási ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Az interferon terápia előtt a szükséges diagnosztikai kritériumok teljesültek-e?
7.2. A betegek beválogatása a Hepatitis Terápiás Bizottság engedélye alapján és a Prioritási Indexnek megfelelően történt-e?
7.3. Történt-e májbiopszia, transiens elastographia vagy más validált nem-invazív módszer a fibrosis stádiumának meghatározására normál GPT esetén?
7.4. A kezelés előtt minden betegnél történt-e PCR vizsgálat?
7.5. A gyógyszeres terápia hossza a beteg labor eredményei alapján alátámasztott és dokumentált-e?
7.5.1. Az algoritmus szerinti időpontokban a szükséges vírusvizsgálat megtörtént-e?
7.5.2. A kezelés hossza ennek megfelelő volt-e?
7.6. A terápia befejezését követően legalább 24 héttel PCR vizsgálat történt-e?
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása
8.2. A finanszírozott algoritmus szerint kezelt betegek aránya
9. A finanszírozás szempontjából lényeges kódok
|
|
BNO |
BNO megnevezés |
|
|
B1820 |
Idült vírusos C-típusú hepatitis |
|
|
OENO |
OENO megnevezés |
|
|
11041 |
Vizsgálat |
|
|
88460 |
Vérvétel |
|
|
99910 |
Kiegészítő pont veszélyeztető beteg ellátásáért |
|
|
28014 |
Vérkép automatával IV. |
|
|
24600 |
Aszpartát-amino-transzferáz (ASAT, GOT) meghatározása |
|
|
24610 |
Alanin-amino-transzferáz (ALAT, SGPT) meghatározása |
|
|
24640 |
Gamma-glutamil-transzferáz meghatározása |
|
|
24720 |
Alkalikus foszfatáz meghatározása |
|
|
24741 |
Pszeudo-kolineszteráz meghatározása |
|
|
21020 |
Összfehérje meghatározása szérumban |
|
|
21040 |
Albumin meghatározása szérumban, festékkötő módszerrel |
|
|
21310 |
Glükóz meghatározása |
|
|
21420 |
Összkoleszterin meghatározása |
|
|
21411 |
Trigliceridek meghatározása |
|
|
21150 |
Összes bilirubin meghatározása szérumban |
|
|
21151 |
Konjugált bilirubin meghatározása szérumban |
|
|
28620 |
Prothrombin meghatározása |
|
|
21120 |
Karbamid meghatározása szérumban |
|
|
21140 |
Kreatin meghatározása |
|
|
2627T |
Hepatitis C vírus AT kimutatása |
|
|
2639A |
HBsAg AG kimutatása |
|
|
26261 |
HIV AT kimutatása |
|
|
24060 |
TSH meghatározása (Thyreoidea-Stimuláló Hormon) |
|
|
25567 |
Hepatitis C vírus kvantitatív meghatározása, molekuláris biológiai módszerrel |
|
|
25566 |
Hepatitis C vírus kvalitatív meghatározása, molekuláris biológiai módszerrel |
|
|
25569 |
HCV genotípus meghatározása molekuláris diagnosztikai módszerrel |
|
|
25572 |
Hepatitis B vírus gyógyszer-rezisztens mutánsainak meghatározása PCR alapú módszerrel |
|
|
29000 |
Szövettani vizsgálat a szokásos feldolgozási módszerrel |
|
|
36130 |
Hasi (áttekintő, komplex) UH-vizsgálat |
|
|
3613D |
Tranziens elasztográfia |
|
|
81581 |
UH vezérelt májbiopsia |
|
|
81580 |
Aspiratio hepatis |
|
|
92231 |
Immunmoduláció |
|
|
91311 |
Krónikus beteg dietetikai alapoktatása (gastroenterológiai, nephrológiai, onkológiai vagy 2. típusú diabeteses betegnél) |
|
|
HBCS |
HBCS megnevezés |
|
|
351B |
Májbetegségek, kivéve rosszindulatú daganatok, cirrhosis |
|
|
9422 |
Kiegészítő HBCs transzplantátummal élő személy ellátására |
|
|
3480 |
Májcirrhosis |
|
|
ATC |
ATC megnevezés |
|
|
L03AB04 |
interferon alfa-2a |
|
|
L03AB01 |
interferon alfa természetes |
|
|
L03AB05 |
interferon alfa-2b |
|
|
L03AB11 |
peg-Interferon alfa-2a |
|
|
L03AB10 |
peg-Interferon alfa-2b |
|
|
J05AB04 |
ribavirin |
|
|
J05AE11 |
telaprevir |
|
|
J05AE12 |
boceprevir |
|
|
J05AE14 |
simeprevir |
|
|
J05AX14 |
daclatasvir |
|
|
J05AX15 |
sofosbuvir |
|
|
J05AX16 |
dasabuvir |
|
|
J05AX67 |
ombitasvir, paritaprevir, ritonavir |
|
|
J05AX65 |
ledipasvir, sofosbuvir |
|
|
J05AX68 |
elbasvir, grazoprevir |
10.1. ALT Alanin aminotranszferáz
10.2. ATC Anatomical Therapeutic Chemical klasszifikáció
10.3. BNO Betegségek nemzetközi osztályozása
10.4. CHC Krónikus hepatitis C
10.5. GPT Glutamát-piruvát transzamináz
10.6. HBCS Homogén betegségcsoport
10.7. HCC HepatoCelluláris Carcinoma
10.8. HCV Hepatitis C vírus
10.9. OENO Orvosi eljárások nemzetközi osztályozása
10.10. PCR Polymerase Chain Reaction
10.11. PegIFN Pegilált interferon
10.12. PI Proteáz inhibitor
10.13. PR Pegilált interferon ribavirin
10.14. RVR Rapid vírusválasz
10.15. eRVR Extended rapid viral response (kiterjesztett rapid vírus válasz)
10.17. StdIFN Hagyományos interferon
10.18. SVR Sustained virologic response (tartós virológiai válasz)
10.19. ABT2D ombitasvir/paritaprevir/ritonavir
10.20. ABT2D ombitasvir/paritaprevir/ritonavir + dasabuvir
8. melléklet a 9/2017. (V. 31.) EMMI rendelethez
„2.8.4. Emelt, indikációhoz kötött társadalombiztosítási támogatással adható új típusú oralis antikoaguláns készítmények
Stroke és szisztémás embolizáció megelőzésére nem billentyű eredetű pitvarfibrillációban szenvedő felnőtt betegeknél,
– K-vitamin antagonista (acenocumarol, warfarin vagy mindkettő) alkalmazásának ellenjavallata esetén vagy
– K-vitamin antagonista kezelés ellenére elszenvedett stroke vagy szisztémás embolizáció esetén, vagy
ha 6 hónapot meghaladó K-vitamin antagonista kezelés során a mért INR értékek kevesebb mint 60%-a esik terápiás tartományba (INR 2 és 3 közé), a következő kockázati tényezők közül legalább kettő fennállása esetén:
– bal kamrai ejekciós frakció <40%,
– tünetekkel járó szívelégtelenség New York Heart Association (NYHA) II. stádium,
– életkor >= 65 év, a következők valamelyikével: diabetes mellitus, koszorúér-betegség vagy hypertonia
Vonatkozó hatóanyagok: dabigatran etexilate, rivaroxaban, apixaban, edoxaban (Eü70 26.).”
|
|
(1 |
ATC |
ATC megnevezés) |
|
|
„ |
|
|
|
|
32 |
B01AF03 |
edoxaban |
9. melléklet a 9/2017. (V. 31.) EMMI rendelethez
„2.3.3.4. Pitvarfibrilláció
A pitvarfibrilláció a stroke erős, független rizikófaktora. TIA-t vagy ischemiás stroke-ot szenvedett betegeket antikoagulálni kell.
Pitvarfibrillációban emelt társadalombiztosítási támogatással adható új típusú oralis antikoaguláns készítmények a vonatkozó Eü70 26. indikációs pont szerint:
Stroke és szisztémás embolizáció megelőzésére nem billentyű eredetű pitvarfibrillációban szenvedő felnőtt betegeknél,
– K-vitamin antagonista (acenocumarol, warfarin vagy mindkettő) alkalmazásának ellenjavallata esetén vagy
– K-vitamin antagonista kezelés ellenére elszenvedett stroke vagy szisztémás embolizáció esetén, vagy
ha 6 hónapot meghaladó K-vitamin antagonista kezelés során a mért INR értékek kevesebb mint 60%-a esik terápiás tartományba (INR 2 és 3 közé), a következő kockázati tényezők közül legalább kettő fennállása esetén:
– bal kamrai ejekciós frakció <40%,
– tünetekkel járó szívelégtelenség New York Heart Association (NYHA) II. stádium,
– életkor >= 65 év, a következők valamelyikével: diabetes mellitus, koszorúér-betegség vagy hypertonia
Vonatkozó hatóanyagok: dabigatran etexilate, rivaroxaban, apixaban, edoxaban (Eü70, 26).
Néhány kiemelt betegcsoport:”
|
|
(1 |
ATC |
ATC megnevezés) |
|
|
„ |
|
|
|
|
32 |
B01AF03 |
edoxaban |
 ”
” ”
”